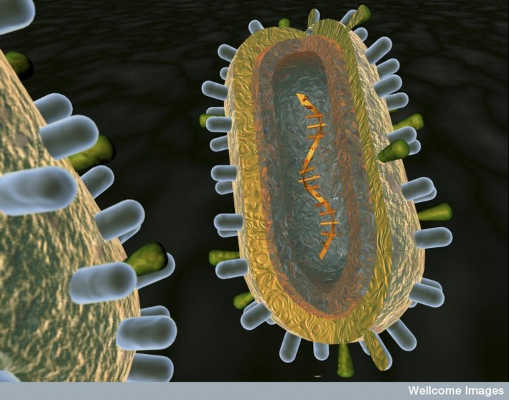
 De weergave van een kunstenaar van de anatomie van een virus. Anna Tanczos / Wellcome Images, CC BY-NC-ND
De weergave van een kunstenaar van de anatomie van een virus. Anna Tanczos / Wellcome Images, CC BY-NC-ND
Niemand wil griep krijgen en de beste verdedigingslinie is het seizoensgebonden griepvaccin. Maar het produceren van een effectieve jaarlijkse griepprik is afhankelijk van nauwkeurig voorspellen welke griepstammen de populatie het meest waarschijnlijk in een bepaald seizoen zullen infecteren. Het vereist de coördinatie van meerdere gezondheidscentra over de hele wereld als het virus van regio naar regio reist. Zodra epidemiologen zich vestigen op doelwitgriesstammen, verschuift de vaccinproductie naar een hogere versnelling; het duurt ongeveer zes maanden om de te genereren meer dan 150 miljoen injecteerbare doses noodzakelijk voor de Amerikaanse bevolking.
Hoe goed werkt het jaarlijkse griepvaccin?
Het produceren van een effectieve jaarlijkse griepprik is afhankelijk van nauwkeurig voorspellen welke griepstammen de populatie het meest waarschijnlijk in een bepaald seizoen zullen infecteren. De CDC voert elk jaar observatiestudies uit om de effectiviteit van het vaccin voor de opname van dat jaar te berekenen.
Onjuiste of onvolledige epidemiologische voorspellingen kunnen grote gevolgen hebben. In 2009, terwijl fabrikanten, waaronder MedImmune en Sanofi Pasteur, waren vaccins aan het voorbereiden tegen de verwachte stammen, extra influenzastam, H1N1, kwam tevoorschijn. Het voorbereide vaccin beschermde niet tegen deze onverwachte stam, waardoor wereldwijde paniek en meer dan 18,000 bevestigde sterfgevallen - waarschijnlijk slechts een fractie van het werkelijke aantal, naar schatting 150,000 overschrijden. Beter laat dan nooit werd uiteindelijk een vaccin tegen H1N1 geproduceerd, waarvoor in dat jaar een tweede griepprik was vereist.
Gezien het feit dat influenza de meerderheid heeft veroorzaakt pandemieën in de afgelopen 100-jaren - inclusief de 1918-griep die resulteerde in maar liefst 50 miljoen doden - we blijven zitten met de vraag: kunnen wetenschappers een "universeel" vaccin produceren dat in staat is om te beschermen tegen diverse soorten griep, een die geen jaarlijkse voorspellingen van epidemiologen en een jaarlijkse opname voor u vereist?
Vaccins stimuleren het immuunsysteem om te vechten
Tegen de 18e eeuw, en aantoonbaar veel eerder in de geschiedenis, was het algemeen bekend dat een de overlevende van de pokken zou er niet weer bovenop komen bij latere blootstelling. Op een of andere manier verleende infectie immuniteit tegen de ziekte. En mensen erkenden dat melkmeisjes die in contact kwamen met vee dat door koeien wordt geroeid, op dezelfde manier beschermd zouden worden tegen pokken.
In de late 1700s, boer Benjamin Jesty heeft zijn gezin ingeënt met koepokken, effectief immuniseren tegen pokken, ondanks toekomstige blootstelling. Arts Edward Jenner heeft vervolgens de mensheid naar een nieuw tijdperk van immunologie gekatapulteerd toen hij de procedure wetenschappelijk onderbouwde.
Dus als één inenting van koepokken of een blootstelling aan (en overleving van) pokken een levenslange immuniteit van tien jaar of zelfs levens verleent, waarom worden mensen dan elk jaar aangemoedigd om het griepvaccin te ontvangen?
Het antwoord ligt in hoe snel de anatomie van het influenzavirus verandert. Elk virus bestaat uit een ruwweg bolvormig membraan dat constant muterend genetisch materiaal omhult. Dit membraan is doorspekt met twee soorten "spikes": hemagglutinine, of HA, en neuraminidase, of NA, elk bestaande uit een steel en een kop. HA en NA helpen het virus met infectie door te binden aan gastheercellen en bemiddelen de invoer van het virus in de cel en uiteindelijk de uitgang ervan.
Vaccins lokken typisch antilichamen uit die op deze twee moleculen zijn gericht. Eenmaal geïnjecteerd, gaat het immuunsysteem van een persoon aan het werk. Gespecialiseerde cellen verzamelen de vaccinmoleculen als indringers; andere cellen genereren dan antilichamen die de vreemde moleculen zullen herkennen. De volgende keer dat diezelfde indringers verschijnen - in de vorm van hetzelfde vaccin of de virusstammen die het nabootst - herkennen de immuuncellen van het lichaam ze en vechten ze af om infectie te voorkomen.
Voor vaccinontwikkelaars is een frustrerend kenmerk van het muterende genoom van influenza hoe snel HA en NA veranderen. Deze constante veranderingen zijn wat hen terugstuurt naar de tekentafel voor nieuwe vaccins in elk griepseizoen.
Verschillende methoden om een vaccin te ontwerpen
Het pokkenvaccin was de eerste die het 'empirische paradigma' van vaccinologie gebruikte - dezelfde strategie die we tegenwoordig grotendeels gebruiken. Het is gebaseerd op een trial-and-error benadering om de immuniteit na natuurlijke infectie na te bootsen.
Met andere woorden, vaccinontwikkelaars geloven dat het lichaam een antilichaamreactie zal krijgen op iets in de inenting. Maar ze focussen niet op welk specifiek stukje van het virus een immuunrespons veroorzaakt. Het maakt niet echt uit of het een reactie is op een klein stukje HA dat veel stammen delen, bijvoorbeeld. Wanneer een volledig virus als uitgangsmateriaal wordt gebruikt, is het mogelijk om veel verschillende antilichamen te krijgen die veel verschillende delen van het virus in het vaccin herkennen.
De seizoensgebonden griepprik past over het algemeen in deze empirische benadering. Epidemiologen voorspellen elk jaar welke griepstammen de populaties het meest waarschijnlijk zullen infecteren, meestal op drie of vier. Onderzoekers verzwakken of inactiveren vervolgens deze stammen, zodat ze kunnen fungeren als de mimiek in het influenzavaccin van dat jaar zonder de ontvangende mens de griep te geven. De hoop is dat het immuunsysteem van een individu op het vaccin reageert door antilichamen te maken die deze stammen aanvallen; dan wanneer hij of zij in contact komt met de griep wachten de antilichamen om die stammen te neutraliseren.
Maar er is een andere manier om een vaccin te ontwerpen. Het wordt rationeel ontwerp genoemd en vertegenwoordigt een mogelijk baanbrekende paradigmaverschuiving in de vaccinologie.
Het doel is om een molecuul te ontwerpen - of "immunogen" - dat ervoor kan zorgen dat effectieve antilichamen worden geproduceerd zonder blootstelling aan het virus. Ten opzichte van de huidige vaccins kan het gemanipuleerde immunogeen zelfs specifiekere reacties mogelijk maken, wat betekent dat de immuunrespons zich richt op bepaalde delen van het virus en een grotere breedte, wat betekent dat het gericht kan zijn op meerdere stammen of zelfs verwante virussen.
Deze strategie werkt om zich te richten op specifieke epitopen of patches van het virus. Omdat antilichamen werken door structuren te herkennen, willen de ontwerpers het structurele systeem de structurele eigenschappen van de immunogenen benadrukken die ze hebben gemaakt. Dan kunnen onderzoekers proberen om kandidaat-vaccins met die structuren te ontwerpen in de hoop dat ze het immuunsysteem zullen provoceren om relevante antilichamen te produceren. Dit pad kan ervoor zorgen dat ze een vaccin samenstellen dat een effectievere en efficiëntere immuunrespons oproept dan mogelijk is met de traditionele trial-and-error-methode.
Veelbelovende vooruitgang is geboekt in vaccinontwerp voor respiratoir syncytieel virus met behulp van dit nieuwe rationele paradigma, maar er zijn nog steeds inspanningen aan de gang om deze aanpak voor influenza te gebruiken.
Op weg naar een universeel griepvaccin
In de afgelopen jaren hebben onderzoekers een aantal krachtige, infleunza-neutraliserende antilichamen geïsoleerd die in ons lichaam worden geproduceerd. Terwijl de antilichaamrespons tegen influenza is voornamelijk gericht op de kop van de HA-spikeer zijn er verschillende gevonden richt HA's stam. Omdat de stengel constanter is over virale stammen dan het hoofd, kan dit de hiel van de griep zijn en antilichamen die zich op deze regio richten, kunnen een goede sjabloon zijn voor vaccinontwerp.
Onderzoekers streven een aantal benaderingen na waardoor het lichaam deze antilichamen van belang kan produceren voordat ze geïnfecteerd raken. Eén strategie, bekend als nanodeeltjesweergave, houdt in het ontwerpen van een molecuul dat een deel van het virus bevat. In het laboratorium konden wetenschappers een combinatie van HA- en NA-deeltjes aan de buitenkant van een bolvormig nanodeeltje binden die zelf een immuunrespons kan veroorzaken. Wanneer het als onderdeel van een vaccin wordt geïnjecteerd, kan het immuunsysteem deze moleculen "zien" en met succes antistoffen tegen hen produceren.
Een van de belangrijkste vragen die moet worden beantwoord, is wat er precies aan de buitenkant van deze nanodeeltjes moet worden weergegeven. Sommige strategieën geven verschillende versies van volledige HA-moleculen weer, terwijl andere alleen stengels bevatten. Hoewel er meer gegevens over mensen moeten worden verzameld om deze benaderingen te valideren, zijn de gegevens van dierstudies met alleenstam-immunogenen zijn bemoedigend.
Met de huidige technologie is er misschien nooit een "één en klaar" griepprik. En epidemiologische surveillance zal altijd nodig zijn. Het is echter niet ondenkbaar dat we van een model van één keer per jaar kunnen overstappen naar een aanpak die eens in de 10-jaren is toegepast, en we zijn misschien nog maar binnen een paar jaar.
![]()
Over de auteur
Ian Setliff, Ph.D. Student, programma in chemische en fysische biologie, Vanderbilt Vaccine Center, Vanderbilt University en Amyn Murji, Ph.D. Student, Afdeling Microbiologie en Immunologie, Vaccincentrum Vanderbilt, Vanderbilt University
Dit artikel is oorspronkelijk gepubliceerd op The Conversation. Lees de originele artikel.
Related Books:
at InnerSelf Market en Amazon






















