Vroeg in de 20 eeuw, Alois Alzheimer beschreef voor het eerst een stoornis van progressief geheugenverlies en verwarring bij een 50-jarige vrouw. Nadat ze was gestorven, onderzocht hij haar hersenen en zag dat deze vol zat met ongewone eiwitmassa's, bekend als plaques. Meer dan een eeuw later weten we dat deze plaques vol zitten met een eiwit dat bèta-amyloïde wordt genoemd en een kenmerk is van de ziekte die de naam van Alzheimer draagt. Hoewel andere kenmerken van de ziekte van Alzheimer zijn ontdekt, heeft de theorie dat beta-amyloïde de hoofdoorzaak van deze ongeneeslijke ziekte is, de overhand gehad.
Er zijn veel subtiele variaties van de "beta-amyloïde hypothese", maar in het algemeen gaat de theorie dat bèta-amyloïde zich ophoopt in de hersenen en dan samenklontert. Ergens in dit proces raken zenuwcellen in de hersenen beschadigd, wat leidt tot geheugenverlies en andere symptomen van de ziekte van Alzheimer. Dus de aanpak om dit te behandelen moet vrij eenvoudig zijn: stop het klonteren en je stopt de ziekte.
Helaas, tientallen jaren van onderzoek, vele miljoenen dollars aan investeringen en vele mislukte klinische proeven later, lijkt het erop dat deze aanpak niet werkt. De meest recente plaque-busting-behandeling om teleurstellende resultaten te produceren, is aducanumab - een op antilichamen gebaseerde therapie die is ontwikkeld om bèta-amyloïde te behouden en te vernietigen.
Eerste gegevens suggereerden dat de behandeling inderdaad beta-amyloïde uit de hersenen wist. Maar deze week, Biogen en Esai, de farmaceutische bedrijven achter aducanumab, beëindigde klinische proeven waarbij duizenden patiënten vroeg betrokken zijn, vermelding dat het "onwaarschijnlijk was dat de" experimenten hun primaire eindpunt na voltooiing bereikten ".
Dit heeft ertoe geleid dat velen zich afvroegen of de amyloïd-hypothese van de ziekte van Alzheimer moest worden opgegeven. In werkelijkheid onderschrijven nog maar weinig neurowetenschappers dat het de bèta-amyloïde plaques zelf zijn die de symptomen van de ziekte van Alzheimer veroorzaken.
Studies met muizen die de menselijke ziekte van Alzheimer nabootsen hebben aangetoond dat geheugenverlies optreedt voordat er zich in de hersenen plaques vormen. Andere studies hebben gesuggereerd dat het de kleinere fragmenten ("oligomeren") van beta-amyloïde zijn die echt toxisch zijn voor zenuwcellen. En er is zelfs gesuggereerd dat de vorming van plaques een manier is voor de hersenen om al deze gevaarlijke oligomeren samen te vatten voor veiligheid.
Het is heel moeilijk om te vertellen zonder de volledige informatie van de aducanumab-studie, maar misschien was de ziekte te ver gevorderd bij de deelnemers om de behandeling effectief te laten zijn. Misschien hadden de kleine bèta-amyloïde oligomeren hun schade al aangericht, waardoor de ziekte in beweging kwam voordat de deelnemers zelfs naar de proef werden gerekruteerd.
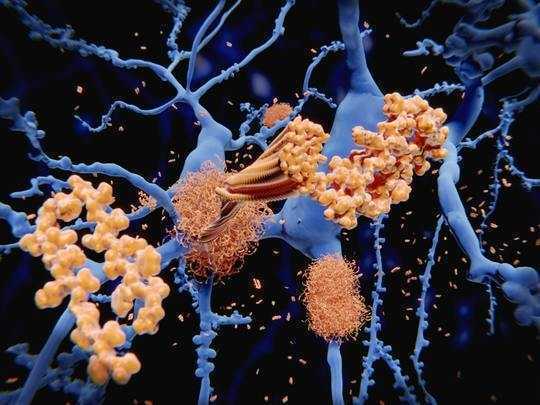 Amyloïde-beta-plaques (geel) klonteren rond hersencellen (blauw). Juan Gaertner / Shuterstock
Amyloïde-beta-plaques (geel) klonteren rond hersencellen (blauw). Juan Gaertner / Shuterstock
De ziekte van Alzheimer versus de ziekte van Alzheimer
Tijdens een recente Alzheimer Research UK-conferentie was er bijna universele overeenstemming dat het tijd is om het concept van de ziekte van Alzheimer te scheiden van de dreiging van dementie.
De ziekte van Alzheimer wordt gedefinieerd als de opbouw van bèta-amyloïde plaques en knopen van een ander eiwit, tau, gecombineerd met enkele milde geheugenveranderingen. Dementie is een symptoom van deze ziekte. Vooruitgang in de beeldvorming van de hersenen betekent dat artsen deze indicatoren van de ziekte van Alzheimer nu veel eerder kunnen herkennen (tot 25 jaar voordat de symptomen van dementie zich voordoen). Een verbazingwekkend te weinig gemeld feit is dat progressie naar dementie geen vanzelfsprekendheid is. Niet alle mensen die deze klinische tekenen van de ziekte van Alzheimer vertonen, zullen in hun leven doorgaan met dementie.
We zijn nog maar net begonnen met het bestuderen van de redenen dat sommige mensen met de ziekte van Alzheimer Alzheimer dementie vermijden. Leeftijd is de grootste risicofactor voor deze progressie; hoe jonger je bent wanneer beta-amyloïde zich begint op te bouwen in de hersenen, hoe meer kans dat je lijdt aan dementie. Dieet, opleiding en hoofdletsel kunnen ook een rol spelen in dit proces, maar in welke mate we dat niet weten.
Een andere belangrijke factor die we nog maar net beginnen te begrijpen, is genetica. Kleine variaties in onze genen lijken niet alleen te beïnvloeden of we een opbouw van beta-amyloïde in de hersenen zullen krijgen, maar of die accumulatie leidt tot dementiesymptomen.
Het proces om deze zogenaamde "risicogenen" te vinden, is echter traag. De voortgang is vooral afkomstig van "big data" -studies die kleine veranderingen in de twee miljard oneven DNA-bases van het menselijk genoom bij tienduizenden individuen volgen en proberen patronen te vinden tussen deze veranderingen en de snelheden van de ziekte van Alzheimer.
Er zijn ongeveer 30-gebieden van het menselijk genoom die verband houden met het risico om de ziekte van Alzheimer te ontwikkelen, hoewel er zeker meer te ontdekken valt.
Aducanumab: juiste behandeling, verkeerde tijd?
Net als bij behandelingen voor veel andere menselijke ziekten, kan het zijn dat behandelingen zoals aducanumab alleen effectief kunnen zijn als ze vroeg genoeg worden gegeven voordat de ziekte onomkeerbare veranderingen heeft veroorzaakt. Een beter begrip van de milieu- en genetische factoren achter de ziekte van Alzheimer in combinatie met steeds gevoeliger beeldvormingstechnieken in de hersenen, zal artsen helpen waarschuwingsborden nog eerder te identificeren, zelfs voordat er zich een gering geheugenverlies voordoet.
Hoewel het screenen en diagnosticeren van mensen - voordat de symptomen zich hebben ingesteld - voor een alsnog ongeneeslijke ziekte, veel ethische dilemma's oproept, kan dit een nieuwe kans bieden om bèta-amyloïde geneesmiddelen, zoals aducanumab, opnieuw te testen. Uiteindelijk moeten we ons onderzoek richten op het begrijpen van de vroege stadia van de ziekte, zodat we de ziekte van Alzheimer kunnen voorkomen voordat dementie optreedt.![]()
Over de auteur
Vicky Jones, hoofddocent celbiologie, Universiteit van Centraal Lancashire
Dit artikel is opnieuw gepubliceerd vanaf The Conversation onder een Creative Commons-licentie. Lees de originele artikel.
Related Books:
at InnerSelf Market en Amazon