Een kenmerk van de ziekte van Alzheimer is de geleidelijke verslechtering van het geheugen. Roman Kraft / Unsplash
De ziekte van Alzheimer is de meest voorkomende vorm van dementie en dat is een overkoepelende term gebruikt om algemeen geheugenverlies, denkvaardigheden en andere dagelijkse functies (zoals koken, rekeningen betalen, schoonmaken en zelfs aankleden) te beschrijven.
Een kenmerk van Ziekte van Alzheimer is een geleidelijke verslechtering van het geheugen. Maar het is een biologische ziekte, wat betekent dat we naast het zien van uiterlijke symptomen zoals geheugenverlies, ook de afbraak kunnen meten die in de hersenen optreedt als gevolg van ziekteprogressie.
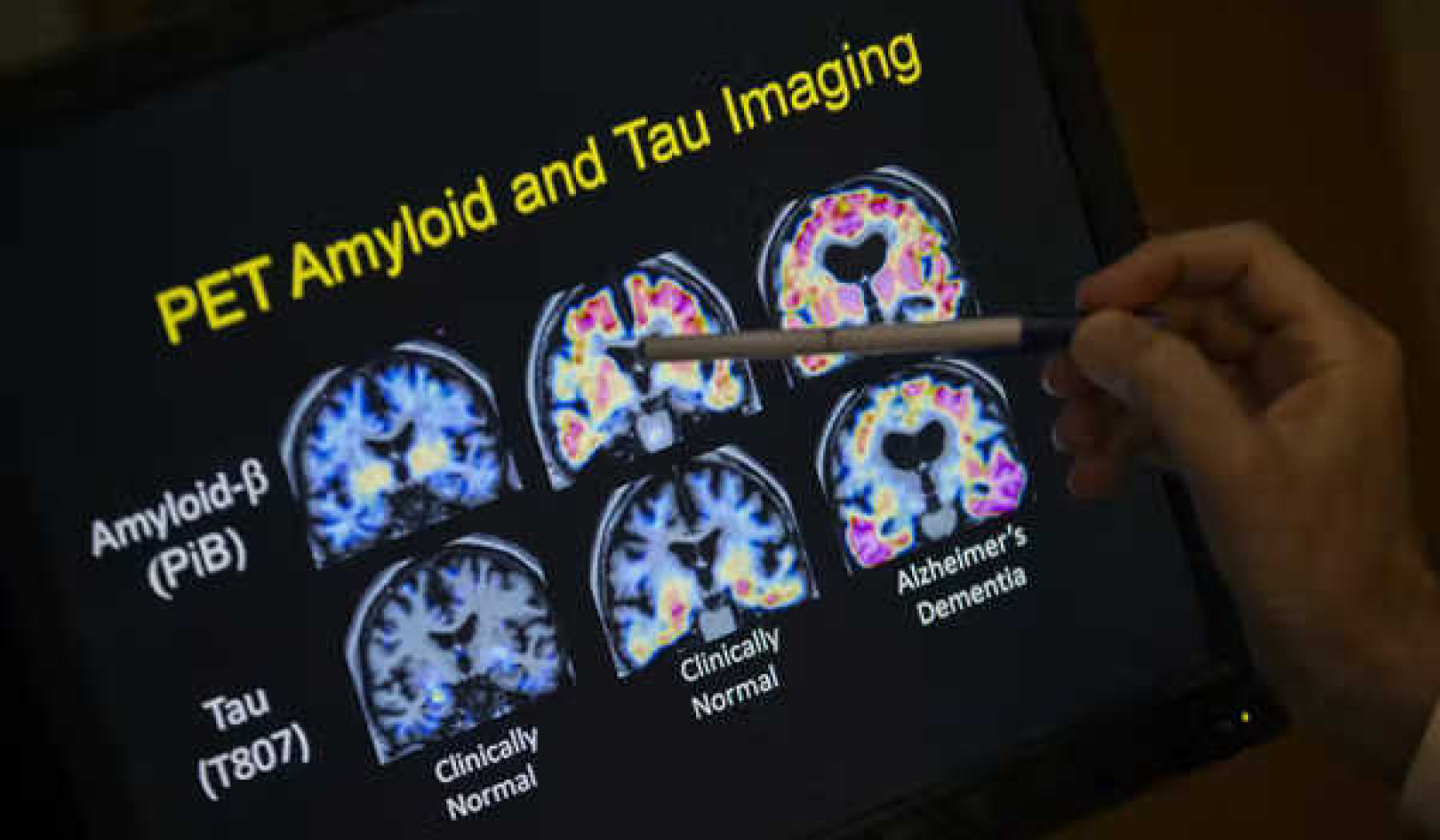
Alzheimer wordt geïdentificeerd door de aanwezigheid van twee eiwitten in de hersenen, bekend als amyloid en Uw. Amyloïde eiwitten aggregeren tot kleverige klonten "plaques" genoemd. En tau-eiwitten hebben de neiging om "klitten" te vormen.
Hoewel het nog steeds onduidelijk is hoe amyloïde en tau op elkaar inwerken om de ziekte te veroorzaken, lijken deze plaques en knopen een rol spelen bij het blokkeren van berichten tussen hersencellen. Ze veroorzaken ontstekingen waar ze zich ook ophopen, en ze kunnen het transportsysteem dat helpt om de hersenen vrij te maken van puin ophopen.
Uiteindelijk veroorzaakt de ziekte de dood van hersencellen. Dit resulteert in een overall krimpen van de hersenen van patiënten met de ziekte van Alzheimer. Momenteel, terwijl mensen kunnen worden gediagnosticeerd met waarschijnlijk de ziekte van Alzheimer, een betrouwbare diagnose kan alleen postmortaal worden gemaakt door te zoeken naar de tau- en amyloïde-eiwitten.
Met hersenbeeldvormingstechnieken kunnen we de niveaus van deze eiwitten bepalen bij mensen die nog in leven zijn. Hoewel abnormale niveaus van de eiwitten in gezonde hersenen de kans op het ontwikkelen van de ziekte van Alzheimer kunnen vergroten, dit resultaat is niet altijd gegarandeerd.
Amyloïde en tau
Het kennen van de biologie en mechanismen achter het ontstaan van de ziekte van Alzheimer is cruciaal voor het succes van de toekomst klinische proeven.
De ophoping van amyloïde-eiwit in de hersenen komt vooral voor bij de ziekte van Alzheimer, samen met de manier waarop het zich verspreidt. Ongeveer 30% van de gezonde volwassenen ouder dan 60 jaar heeft hoge amyloïdeconcentraties in de hersenen. Het duurt ongeveer 20 jaar voordat mensen in deze groep dementiesymptomen zoals geheugenverlies gaan vertonen.
tau, aan de andere kant, wordt gevonden in een breed scala van omstandigheden. Deze omvatten de ziekte van Alzheimer, chronische traumatische encefalopathie (een neurodegeneratieve ziekte die verband houdt met herhaalde hersenschudding en hersentrauma), Niemann-Pick ziekte (een erfelijke ziekte die het vetmetabolisme in cellen beïnvloedt) en Syndroom van Down.
Dierstudies suggereren een reeks van tau "stammen" bestaan, zoals "prionen”. Prionen zijn klein, besmettelijk en abnormaal gedraaide (of verkeerd gevouwen) eiwitten die de hersenen kunnen beïnvloeden door ervoor te zorgen dat normaal functionerende eiwitten in zieke kopieën veranderen.
Dit, en het feit dat tau-eiwitten aanwezig zijn in een reeks aandoeningen, maakt het moeilijk om de tau-stammen te bepalen die specifiek zijn voor de ziekte van Alzheimer.
Wij zijn nog in de vroege stadia van het bestuderen van tau in de hersenen. Dusver, bevindingen suggereren verhoogde tau in geheugengerelateerde gebieden van de hersenen hangt nauw samen met geheugenverlies, zelfs bij gezonde oudere volwassenen.
Maar hoe amyloïde plaques en tau-klitten op elkaar inwerken om het begin van de ziekte van Alzheimer te beïnvloeden, blijft een raadsel voor onderzoekers. Amyloïde begint eerst verschijnen in de buitenste randen van de hersenen (wat we de "cortex" noemen), waar cognitieve functies van hogere orde zich bevinden.
tau verschijnt eerst diep in de hersenen, heel vroeg in de gebieden van de hersenstam die verband houden met slaap, opwinding en waakzaamheid, en vervolgens in geheugen centra zoals de entorhinale cortex en de hippocampus.
Interessant is dat hoewel hoge niveaus van amyloïde plaques kunnen worden waargenomen bij gezonde oudere volwassenen, de plaques de cognitieve functie niet in dezelfde mate lijken te beïnvloeden als tau-klitten. Dit heeft ertoe geleid dat sommige onderzoekers dat hebben gesuggereerd amyloïde is noodzakelijk, maar op zichzelf niet voldoende, leiden tot dementiesymptomen.
Een andere grote vraag is wat eerst komt, amyloïde of tau? Een baanbrekend autopsieonderzoek van 2,332 hersenen tussen de tien en 90 jaar oud toonde aan dat tau al in de twintig verschijnt en zich gedurende het hele leven zal blijven ophopen, zelfs bij gezonde mensen, tot aan de dood.
Een werkhypothese is dat zodra amyloïde op het toneel verschijnt, tau zal het verkeerd vouwen versnellen, welke zal bevorderen meer amyloïde en hersenceldood. Een veelgebruikte analogie is dat tau het "pistool" vertegenwoordigt en amyloïde de "kogel".
De rol van genen
Dus hoe verschijnt amyloïde in de eerste plaats op het toneel? Genen kan een belangrijke rol spelen.
Als u het gen voor de ziekte van Alzheimer van slechts één ouder erft en toch de ziekte krijgt, staat dit bekend als dominant erfelijke ziekte van Alzheimerof familiale of autosomaal dominante ziekte van Alzheimer. Hier, mutaties in een van de drie genen (amyloïde precursor-eiwit, preseniline 1 of preseniline 2) veroorzaken een snelle ophoping van amyloïde in de hersenen.
Dit resulteert in ernstig verlies van hersenvolume en geheugen op een verschrikkelijk jonge leeftijd (ongeveer 40 jaar oud). Dominant erfelijke ziekte van Alzheimer is zeldzaam in Nederland Australische bevolking, goed voor slechts 1% van alle gevallen van de ziekte van Alzheimer.
Mensen die drager zijn van deze mutaties hebben echter 99.9% kans om de ziekte te ontwikkelen en 50% kans om de mutaties door te geven aan hun kinderen.
Amyloïde hoopt zich ook op met de leeftijd. Leeftijd is de grootste risicofactor voor sporadische ziekte van Alzheimer (die goed is voor 99% van de gevallen van de ziekte van Alzheimer). Aangezien de gemiddelde aanvangsleeftijd voor de sporadische ziekte van Alzheimer 80 is, wordt het soms de ziekte van Alzheimer met late aanvang genoemd.
De sterkste genetische risicofactor voor sporadische ziekte van Alzheimer is een gen genaamd "apolipoproteïne E (APOE) ?4”, en opkomend onderzoek suggereert dat dit verhoogde risico te wijten kan zijn aan inefficiëntie bij het opruimen van amyloïde uit de hersenen. Het ?4-gen is zelf niet voorspellend of diagnostisch voor de ziekte van Alzheimer. Slechts 40% van de patiënten draagt het ?4-gen, en veel dragers ontwikkelen de ziekte niet.
Dieet, diabetes en obesitas
Dieet is lang gezien als een mogelijke preventieve factor tegen het risico op dementie. De effecten van voedingssupplementen (zoals omega-III-vetzuren) en het volgen van specifieke diëten (zoals de Mediterraan dieet) niet geheel overtuigend geweest. Er is nog geen bewijs dat een bepaald dieet of supplement een substantieel effect heeft op het verminderen van het risico op dementie of zelfs op geheugenverlies.
Een beetje bewijs link diabetes type 2 met risico op de ziekte van Alzheimer. Maar er is sterkere steun voor een associatie tussen gewicht (body mass index of BMI) en dementie.
Een hogere BMI (boven de 40) wordt in verband gebracht met een groter risico op vroegtijdig overlijden en een verhoogd risico op dementie in vergelijking met mensen met een normaal gewicht. Er zijn ook aanwijzingen dat mensen met een lagere BMI (jonger dan 18 jaar) op middelbare leeftijd en daarna een aanzienlijk verhoogd risico op dementie hebben in vergelijking met mensen met een gezond bereik (18.5 tot 25).
Een recent artikel suggereert lage BMI veroorzaakt geen ziekte van Alzheimer maar die lagere BMI kan ontstaan als gevolg van hersenveranderingen, zoals onderdrukking van de eetlust, die vroeg optreden als gevolg van de ziekte.
Sommige studies hebben ook gesuggereerd dat de ziekte van Alzheimer kan worden genoemd "type 3" diabetes, aangezien patiënten een lager energieverbruik in de hersenen vertonen. Sommige onderzoekers suggereren dat dit wordt veroorzaakt door insulineresistentie. Dit is echter een controversieel gebied van onderzoek en studieresultaten hebben daarom onafhankelijke replicatie nodig.
Lichamelijke activiteit
Studies suggereren nu oefening neuroplasticiteit kan verhogen in de hersenen. Neuroplasticiteit verwijst naar het vermogen van de hersenen om nieuwe verbindingen tussen zenuwnetwerken te vormen, met name in geheugencentra.
Zweten mag niveaus van een eiwit verhogen de van de hersenen afgeleide neurotrofe factor genoemd, die de groei en overleving van hersencellen induceert. Net zoals eiwitshakes spieren kunnen helpen groeien na het sporten, kan dit eiwit dat ook het vermogen van de hersenen versterken om te gaan met letsel of ziekte, niet alleen de ziekte van Alzheimer.
Slaap
Slaap problemen komen vaak voor bij patiënten met de ziekte van Alzheimer. Het is waarschijnlijk dat hersengebieden die de slaap-waakcycli reguleren, verslechteren, wat resulteert in slaapverstoringen.
Dierstudies suggereren dat verstoorde slaap kan leiden tot verhoogde amyloïde-accumulatie. Dit komt doordat een afvalafvoersysteem (bekend als het glymfatische systeem waarvan wordt aangenomen dat het betrokken is bij het opruimen van amyloïde uit de hersenen) wordt beduidend actiever wanneer mensen slapen, en minder effectief tijdens slaapverstoring.
Terwijl het onderzoek naar de mechanismen achter slaap en amyloïdklaring zich nog in de beginfase bevindt, ondersteunt steeds meer bewijs het idee van slaapstoornissen, of abnormale slaappatronen, kan vroeg zijn indicator van de ziekte van Alzheimer.
Stemming
Depressie op oudere leeftijd is in verband gebracht met een verdubbeld risico op het ontwikkelen van dementie. recent bewijs suggereert ook angst, stress en verhoogde cortisolspiegels (stresshormoon) kunnen een rol spelen.
Hoewel de mechanismen die verklaren hoe stemming het risico op dementie kan verhogen, onduidelijk blijven, studies suggereren Symptomen van angst of depressie kunnen in verband worden gebracht met factoren die uw risico op vasculaire aandoeningen zoals hartaandoeningen en beroertes verhogen.
Ze zijn ook in verband gebracht met toenemende niveaus van amyloïde in de hersenen en verhoogde ontsteking.
Cognitieve reserve of veerkracht
Sommige mensen met een hoog amyloïdegehalte in hun hersenen ontwikkelen de ziekte van Alzheimer niet. Er wordt gesuggereerd dat deze mensen "cognitieve reserve" hebben, waardoor ze daartoe in staat zijn beter compenseren voor, of veerkrachtiger zijn tegen, toenemende ziekteniveaus in de hersenen.
Deze term "cognitieve reserve" verwijst naar alle psychologische en sociale factoren (zoals hoger opleidingsniveau, beroepsniveau of intelligentie) die de kans op het compenseren van ziektelast zou kunnen vergroten.
Ander onderzoek suggereert echter dat personen met cognitieve reserve ook meer kans hebben om a te vertonen plotselinge en steile daling geheugenprestaties in een later stadium, in tegenstelling tot de "langzame en gestage" achteruitgang die kenmerkend is voor de meeste gevallen van de ziekte van Alzheimer. Als zodanig, hoewel cognitieve reserve tot op zekere hoogte beschermend kan zijn, kan het het begin van de ziekte eenvoudigweg vertragen.
De ziekte van Alzheimer voorkomen
Terwijl een genezing blijft ons ontgaan, realiseren veel Alzheimer-experts zich nu vroege diagnose en interventie is de sleutel tot het stoppen van de ziekte in zijn sporen.
Als het krimpen van de hersenen al is begonnen, is het onwaarschijnlijk dat het verwijderen van amyloïde uit de hersenen effectief zal zijn. Recent klinische proeven, waarbij amyloïde plaques werden verwijderd uit de hersenen van patiënten met de ziekte van Alzheimer, toonden cognitieve prestaties en klinische symptomen verbeterden niet drastisch in de loop van het onderzoek.
Experts op het gebied van klinische proeven zijn dat wel hun blik draaien naar eerdere stadia in het ziektetraject. Bijvoorbeeld, Australische onderzoekers werven deelnemers voor een studie die medicijnen zal testen die gericht zijn op het verwijderen van amyloïde bij gezonde oudere volwassenen met hoge niveaus van amyloïde plaques.
Bovendien proberen wij en andere wetenschappers factoren te begrijpen die bijdragen aan amyloïde-accumulatie, zodat het kan worden gestopt voordat het zelfs maar begint.
Dit houdt in dat volwassenen van middelbare leeftijd worden bestudeerd en gedurende een lange tijd worden gevolgd om te bepalen welke combinaties van genetische en omgevingsfactoren mensen het risico op de ziekte van Alzheimer geven of hen ertegen beschermen. Als je deel wilt uitmaken van zo'n onderzoek onder Australiërs van middelbare leeftijd, kun je naar de Gezond hersenproject.
Hoewel de hersentrainingssector jaarlijks miljoenen dollars waard is, is dat wel zo geen overtuigend bewijs dat hersentraining (computerprogramma's gericht op het verbeteren van je geheugen door middel van spelletjes en puzzels) dat wel kan resulteren in betere cognitieve vaardigheden in het dagelijkse leven.
![]() Maar het behouden van fysieke, sociale en hersengezondheid is een belangrijk onderdeel van het verminderen van het risico op dementie, die alle Australiërs in hun dagelijks leven kunnen implementeren. Een nieuwe taal leren, bridge oppakken, reizen en weer gaan studeren zijn ideale voorbeelden omdat ze hersenuitdagingen bevatten en sociale betrokkenheid vergroten, die beide belangrijk zijn voor het dynamisch betrekken van de hersenen.
Maar het behouden van fysieke, sociale en hersengezondheid is een belangrijk onderdeel van het verminderen van het risico op dementie, die alle Australiërs in hun dagelijks leven kunnen implementeren. Een nieuwe taal leren, bridge oppakken, reizen en weer gaan studeren zijn ideale voorbeelden omdat ze hersenuitdagingen bevatten en sociale betrokkenheid vergroten, die beide belangrijk zijn voor het dynamisch betrekken van de hersenen.
Over de auteur
Yen Ying Lim, Research Fellow, Florey Institute of Neuroscience and Mental Health en Rachel Buckley, Research Fellow, Harvard Medical School, Research Fellow, Florey Institute of Neuroscience and Mental Health
Dit artikel is oorspronkelijk gepubliceerd op The Conversation. Lees de originele artikel.
Related Books:
at InnerSelf Market en Amazon