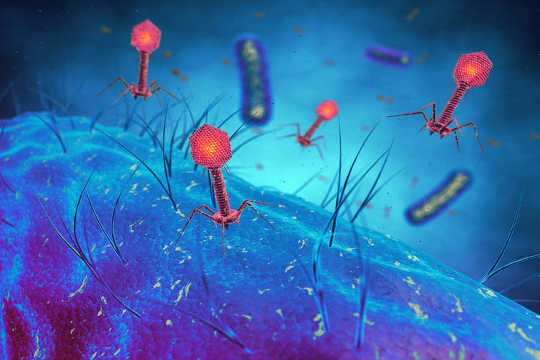
 Bacteriofaag-virussen die bacteriële cellen infecteren, bacteriële virussen. van www.shutterstock.com
Bacteriofaag-virussen die bacteriële cellen infecteren, bacteriële virussen. van www.shutterstock.com
Tegenwoordig is de wetenschappelijke gemeenschap verbluft over het vooruitzicht van het bewerken van genen om te creëren "Designer" mensen. Het bewerken van genen kan van groter belang zijn dan klimaatverandering, of zelfs de gevolgen van het ontketenen van de energie van het atoom.
CRISPR is een afkorting voor Clustered Regularly Interspaced Short Palindromic Repeats. Dit is het immuunsysteem dat bacteriën ontwikkelden om zichzelf te beschermen tegen infecties door bacteriofagen - de meest voorkomende levensvorm op aarde.
Kleiner dan elke bekende levensvorm
Bacteriofagen werden ontdekt in Parijs door Felix d'Hérelle de Pasteur Institute in 1917. Hij bestudeerde een subgroep van patiënten die spontaan herstelden van dysenterie. D'Hérelle stelde voor dat een antimicrobe die kleiner is dan enige bekende levensvorm de bacteriën bij geïnfecteerde patiënten had gedood. Hij toonde overtuigend het bestaan van deze nieuwe levensvorm en noemde ze bacteriofagen: virussen die bacteriën aanvallen.
De bacteriofaag is intensief bestudeerd: zijn schoonheid werd onthuld met de elektronenmicroscoop en het genoom was de eerste levensvorm gesequenced.
Reageren op een aanval met bacteriofagen
In 2007 werkten Rodolphe Barrangou en Philippe Horvath van het voedselproductiemaatschappij Danisco samen met Sylvain Moineau van Laval University een al lang bestaand probleem bij de productie van yoghurt op. Ze vroegen: waarom waren bacteriën die essentieel waren voor de productie van yoghurt en kaas vatbaar voor aanvallen door bacteriofagen, en hoe kon dit worden voorkomen?
Barrangou, Horvath en Moineau maakten de verbazingwekkende ontdekking dat bacteriën eigenlijk een immuunsysteem hadden.
CRISPR: Verworven Bacteriële Immuunsystemen.
{youtube}yW0yA3qoH9A{/youtube}
Na een eerste bacteriofaagaanval, zou een klein aantal overlevende bacteriën het DNA van de nieuw aanvallende bacteriofagen herkennen. De overlevende bacteriën zouden dan een immuunrespons opbouwen die leidt tot de dood van de bacteriofagen. De bacteriën die een faagaanval overleefden, zouden een fragment van bacteriofaag-DNA in hun bacterieel genoom insluiten om als een "geheugen" van de infectie te dienen.
Target en verdeel
Barrangou, Horvath en Moineau dan ontdekt hoe de binnendringende bacteriofagen werden geëlimineerd. Na herkenning van de nieuw binnendringende bacteriofaag, zouden de bacteriën zich richten op het DNA van de binnenvallende bacteriofaag.
Fond de recherche de Québec: CRISPR-Cas9: L'origine de la découverte | Sylvain Moineau.
{youtube}Bz0aN5qEkyw{/youtube}
Biologen Jennifer Doudna en Emmanuelle Charpentier ontdekten verder dat "begeleidt" was geëvolueerd in het bacteriële immuunsysteem. Elke bacteriofaag waarvan het DNA overeenkwam met het verkregen geheugenfragment van een eerdere infectie zou worden herkend en verbroken door een "geleid" eliminatiemachinerie. Samen zijn het bacteriële immuunsysteem met geheugenfragmenten van het bacteriofaag-DNA en de bacteriële responssystemen bekend als het CRISPR-Cas9-systeem.
Commerciële exploitatie van de ontdekking gevolgd. Doudna, Charpentier en anderen erkennen dat dit nieuwe biologische systeem kan worden uitgebuit om genen in elke levensvorm te bewerken.
Bozeman Science: Wat is CRISPR?
{youtube}MnYppmstxIs{/youtube}
Het CRISPR-Cas9-systeem is niet het eerste gen-bewerkingssysteem dat ontdekt wordt. De late biochemicus Michael Smith, aan de universiteit van British Columbia, ontving een Nobelprijs in 1993 voor de ontdekking van een chemisch middel voor genbewerking met toepassingen die relevant zijn voor kanker en andere ziekten.
UBC Science: The Legacy of Dr. Michael Smith.
{youtube}khYP1dN5nRg{/youtube}
Bacteriofagen als een potentiële oplossing
D'Hérelle merkte op dat dezelfde bacteriofaag, geïsoleerd van patiënten die herstellen van dysenterie, kon worden gebruikt om konijnen te beschermen tegen een anders dodelijke infectie. Vóór de ontdekking van antibiotica, werd de ontdekking van d'Hérelle geïnspireerd Sinclair Lewis om de bacteriofaagtherapie van mensen in zijn Pulitzer Prize-winnende roman Arrowsmith.
Een van de grootste verzameling bacteriofagen wereldwijd is op Laval University. Sylvain Moineau is de curator en de collectie is vernoemd naar Felix d'Hérelle.
De hoop is nu dat bacteriofaagtherapie kan worden beschouwd als een mogelijke oplossing voor resistentie tegen antibiotica. De verwachtingen van faagtherapie worden echter overschaduwd door de huidige exploitatie van de commerciële voordelen van het CRISPR-Cas9-systeem.
Vandaag de dag, de gevolgen van het openen van een Pandora's Box zijn bij ons. De toepassing van het CRISPR-Cas9-systeem om designer-mensen te genereren door middel van 'kiemlijn'-genbewerking van geoogste menselijke eieren zou permanente veranderingen creëren die zich door opeenvolgende generaties blijven voordoen, en de angsten voor deze acties kunnen vergelijkbaar zijn met de gevolgen van nucleaire oorlogsvoering en klimaatverandering.
Maar er zijn andere mogelijke toepassingen van CRISPR-Cas9 "niet-kiemlijn", zoals het bewerken van genen bij ziekten. Dit is onlangs succesvol uitgevoerd voor spierdystrofie bij honden. Akin naar de mythe van Pandora's Box, het pessimisme over "kiemlijn" -gen editing kan worden gecompenseerd door de hoop op toekomstig voordeel voor de mensheid.
{youtube}lXmHA-XySmk{/youtube}
Over de auteur
John Bergeron, Emeritus Robert Reford Professor en hoogleraar Geneeskunde bij McGill, McGill University. John Bergeron erkent dankbaar Kathleen Dickson als co-auteur.![]()
Dit artikel is opnieuw gepubliceerd vanaf The Conversation onder een Creative Commons-licentie. Lees de originele artikel.
Verwante Boeken
at InnerSelf Market en Amazon